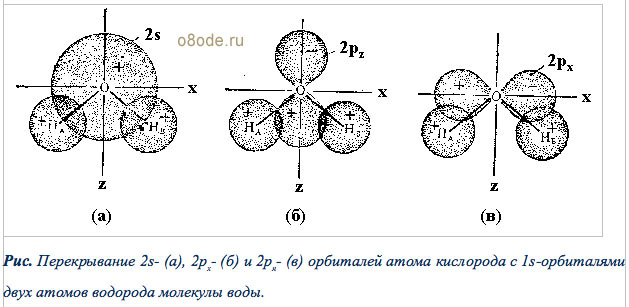
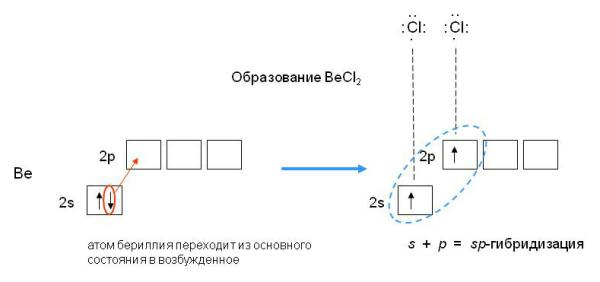
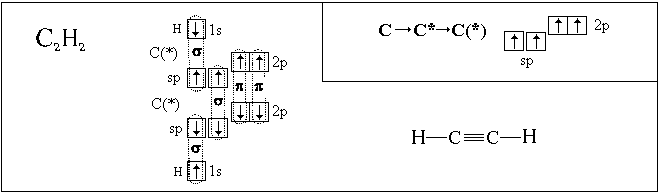
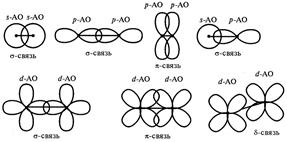
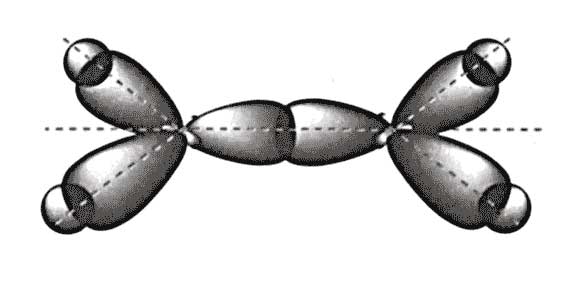
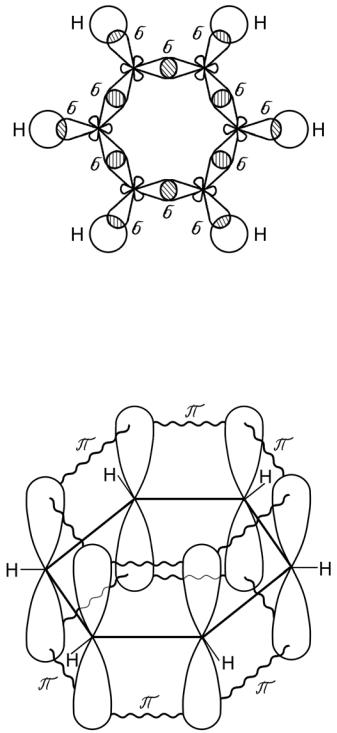
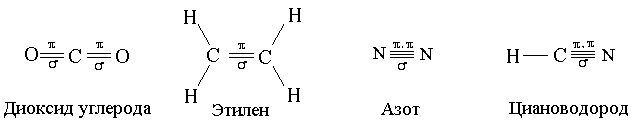
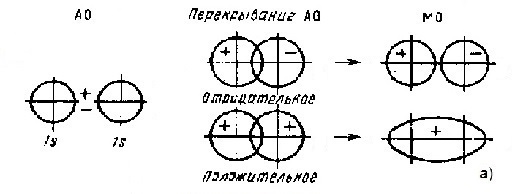
Орбитальные схемы перекрывания электронных облаков в молекулах
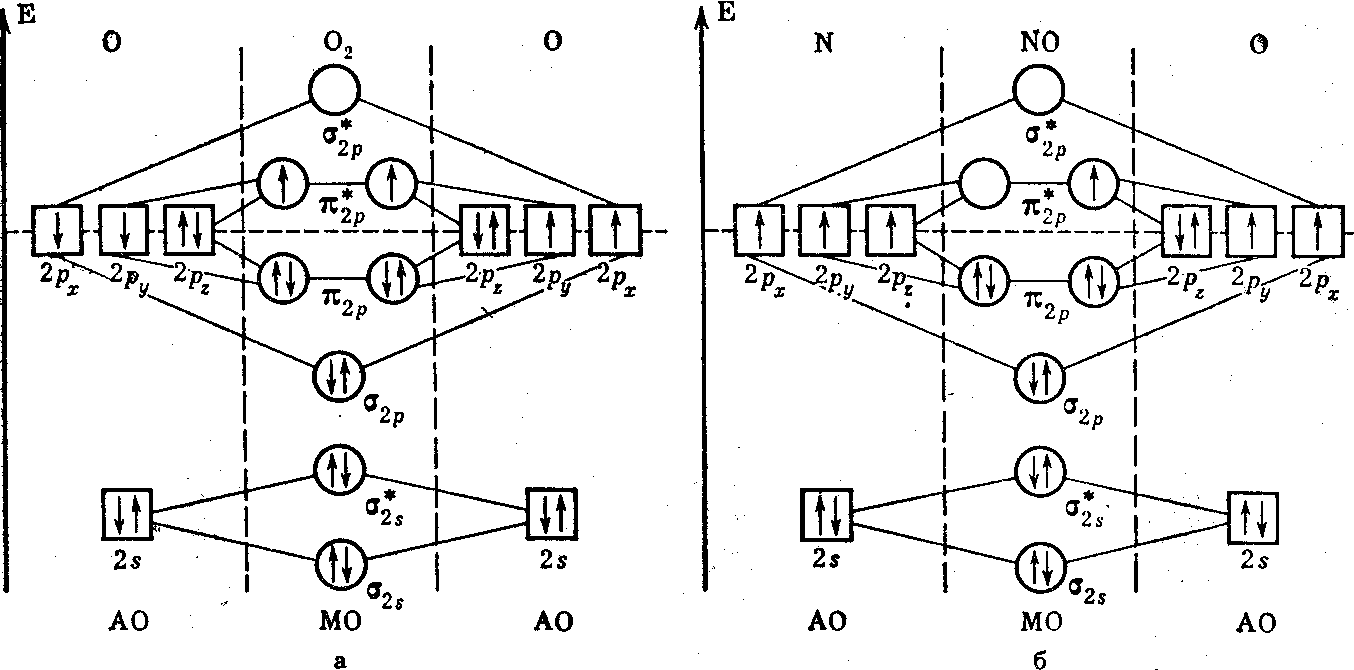
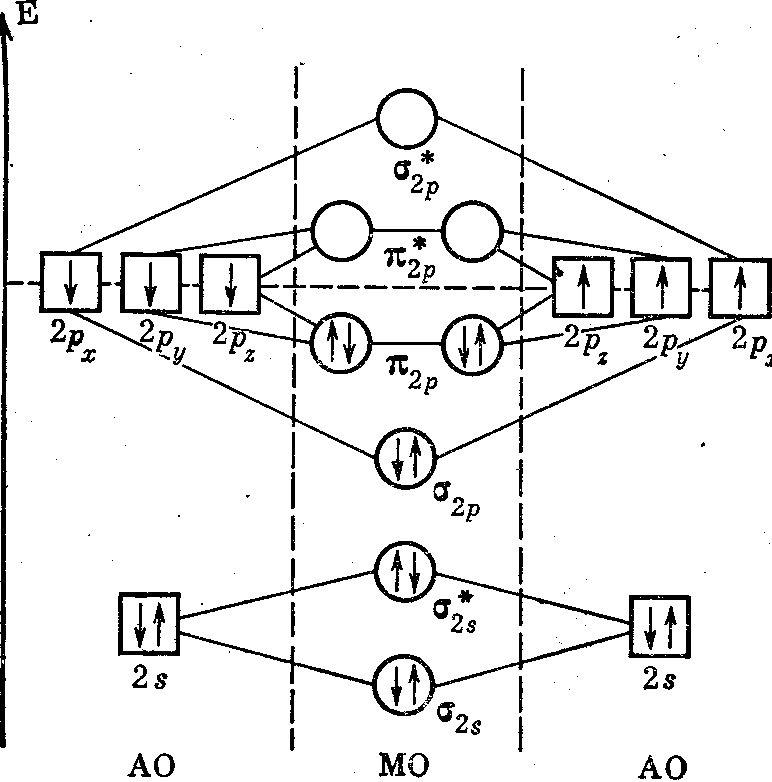
Молекулярные орбитали HF
В годах Ф. Хунд, Дж. Леннард- Джонс и Р. Малликен развили идею нового подхода к поиску волновой функции молекулы, известного под названием метода молекулярных орбиталей МО. Он является наиболее универсальным квантовомеханическим методом описания химической связи. Если в методе валентных схем волновая функция молекулы строится исходя из комбинаций волновых функций, образующих молекулу атомов, то в методе МО полная волновая функция молекулы строится из функций, описывающих поведение отдельных электронов в поле, создаваемом остальными электронами и всеми атомными ядрами, которые образуют молекулярный остов.


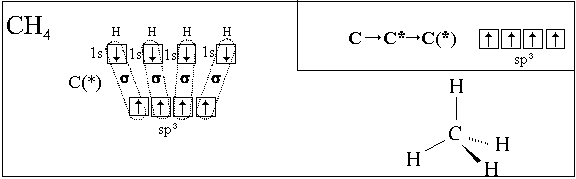
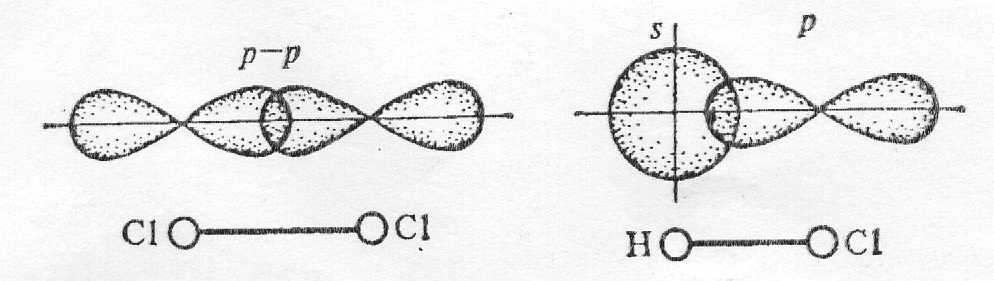
Пример 1. По положению в периодической системе: а рассмотрите строение электронных оболочек атома кремния; б составьте электронную формулу и графическую схему заполнения электронами валентных орбиталей атома в нормальном и возбужденном состояниях. Следовательно, в атоме кремния 14 электронов, которые расположены на 3-х энергетических уровнях. На внешнем валентном уровне находятся 4 3s 2 3p 2 , то есть кремний относится к р -электронному семейству;. Валентными орбиталями в этом атоме являются орбитали внешнего третьего электронного уровня, то есть 3 s - и З р - орбитали и не заполненные З d -орбитали. Графическая схема заполнения электронами этих орбиталей в нормальном состоянии имеет следующий вид в соответствии с правилом Гунда :.

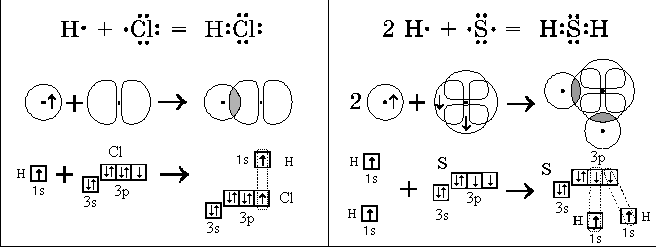

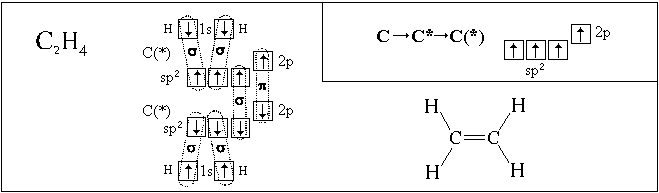
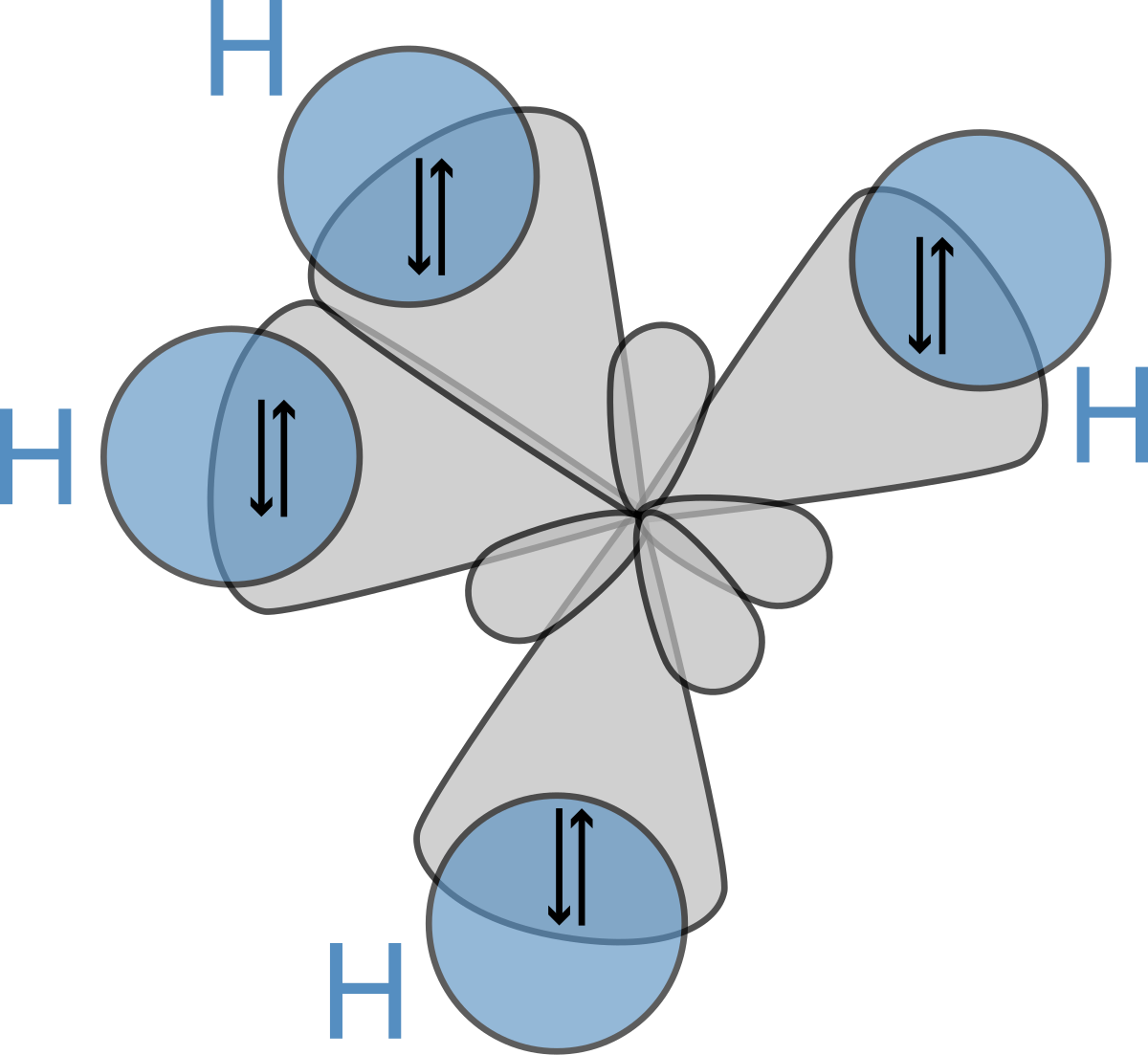
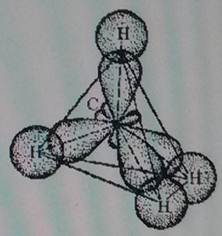
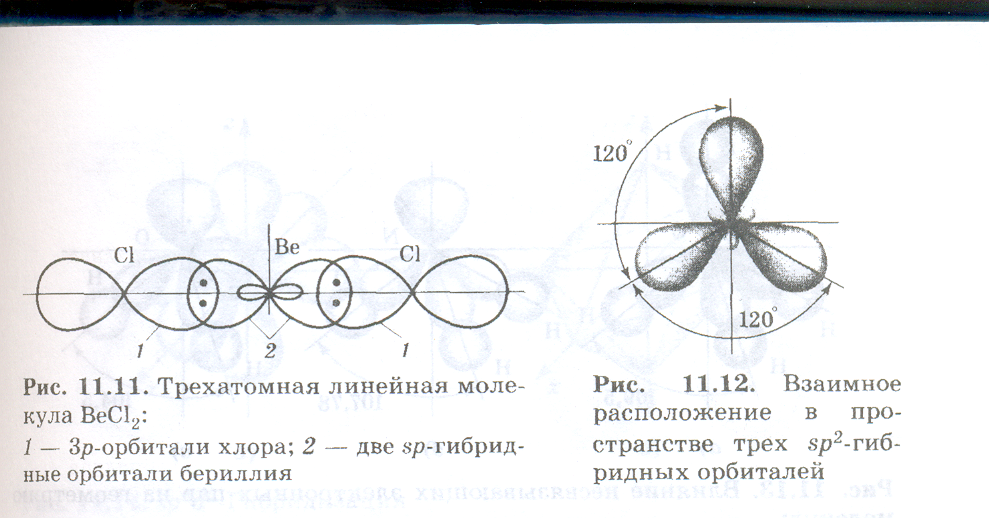
| 150 | Четыре sp3-орбитали образуют тетраэдр, в углах данного тетраэдра образуют связи с шарообразной орбиталью H и тремя гантелеобразными орбиталями Cl. Нарисовать попробуйте сами. | |
| 332 | Глинка, Н. | |
| 430 | Содержит необходимые теоретические сведения о химической связи, строении вещества, комплексных соединениях, а также разн. Russian Pages | |
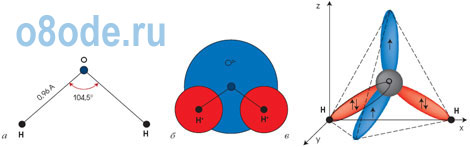
| 168 | Молекула воды состоит из атома кислорода и двух атомов водорода. Два неспаренных р-электрона атома кислорода занимают две орбитали, которые располагаются под углом 90 o друг к другу. | |
| 172 | Объясните с точки зрения строения атомов и с учетом оценки значений относительной электроотрицательности ОЭО характер изменения свойств элементов в периодах и группах ПС табл. | |
| 40 | С нами работают преподавателей из областей знаний. Мы публикуем только качественные материалы. | |
| 67 | Регистрация Вход. Ответы Mail. |
Цель занятия : Формирование навыков составления электронных формул невозбужденных и невозбужденных атомов и одноатомных ионов; умения характеризовать электроны атомов значениями квантовых чисел и определять свойства элементов и их соединений в зависимости от положения в периодической системе; формирование и закрепление представлений о пространственном строении веществ. Согласно квантово-механическим представлениям состояние каждого элемента в атоме определяется значениями четырех квантовых чисел n, l, m l , m s. Главное квантовое число n характеризует уровень энергии электрона в атоме и принимает целочисленные значения: 1, 2, 3, …, n. Орбитальное квантовое число l характеризует энергию электрона на подуровне и определяет форму электронного облака рис.